Anvisa atualiza regulamentação sobre Farmacovigilância
A Agência Nacional de Vigilância Sanitária (ANVISA) publicou em 29/07/2020 a Resolução RDC nº 406/2020 e a Instrução Normativa nº 63/2020 a fim de atualizar a regulamentação sobre Farmacovigilância. Este novo marco regulatório é resultado de amplo debate entre a ANVISA e o setor produtivo através de consultas públicas.
Tanto a Resolução RDC nº 406/2020 quanto a IN nº 63/2020 foram aprovadas, de maneira unânime, na 12ª Reunião Ordinária Pública da Diretoria Colegiada da ANVISA, realizada dia 21 de julho.
A Resolução RDC nº 406/2020 inaugura um novo marco regulatório e trata das Boas Práticas de Farmacovigilância, revogando a Resolução RDC nº 4/2009 – antiga responsável por estabelecer as normas do setor. Enquanto a IN nº 63/2020 trata do Relatório Periódico de Avaliação Benefício-Risco (RPBR) que deve ser submetido à ANVISA, atualizando a antiga IN nº 14/2009.
Entendemos que as práticas de monitoramento pós-comercialização foram formalizadas e/ou aperfeiçoadas. Algumas das alterações referem-se ao seguinte:
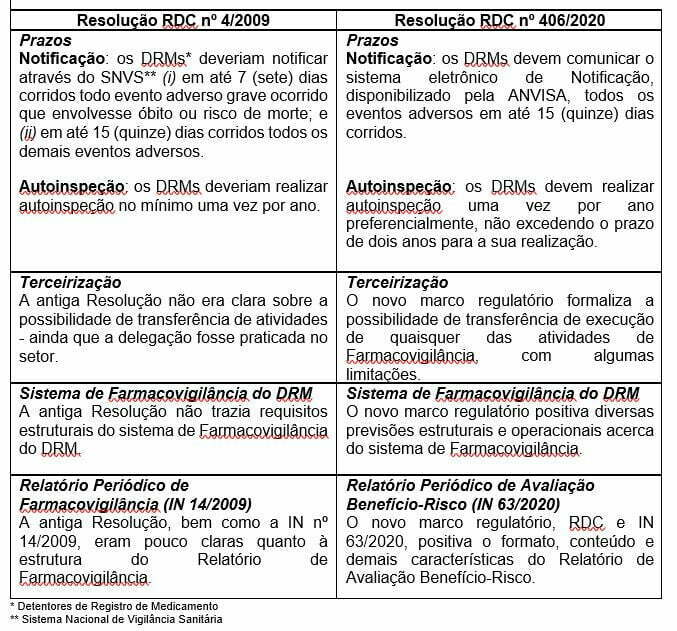
A Resolução RDC nº 406/2020 e a Instrução Normativa nº 63/2020 também atualizam outros aspectos bastante interessantes ao setor e deve ser avaliada com bastante critério.
A Resolução RDC nº 406/2020 e a Instrução Normativa nº 63/2020 entram em vigor em 90 dias a contar da publicação.